Atombindung (Elektronenpaarbindung) oder besser kovalente Bildung ist eine Möglichkeit Atome zu Molekülen zu verbinden. Dabei ist die Wechselwirkung der Außenelektronen (Valenzelektronen) mit den Atomkernen der beteiligten Atome bedeutend. Die Atome bilden mindestens ein Elektronenpaar aus, das zwei oder mehr Atome zusammenhält und deshalb bindendes Elektronenpaar genannt wird. Neben einem bindenden Elektronenpaar (Einfachbindung) können auch zwei (Doppelbindung) oder drei (Dreifachbindung) Elektronenpaare wirken.
Beispiel: Sauerstoffmolekül aus zwei Sauerstoffatomen
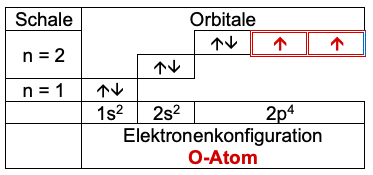
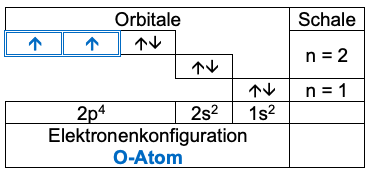 Die beiden Sauerstoffatome haben jeweils sechs Valenzelektronen in drei Orbitalen, von denen jeweils zwei einfach mit einem Elektron besetzt sind.
Die beiden Sauerstoffatome haben jeweils sechs Valenzelektronen in drei Orbitalen, von denen jeweils zwei einfach mit einem Elektron besetzt sind.
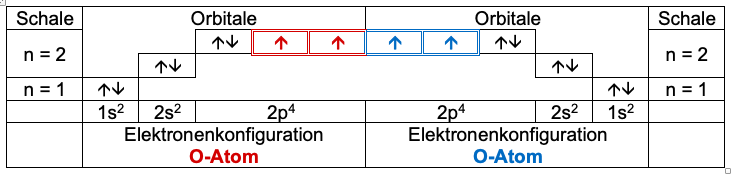
Die Atomhüllen “berühren” einander.
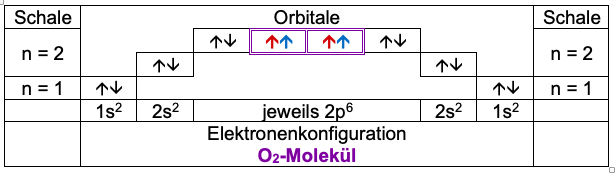
Die Atomhüllen überlappen sich, dabei überlagern sich Orbitale und werden mit jeweils einem Elektron aufgefüllt.
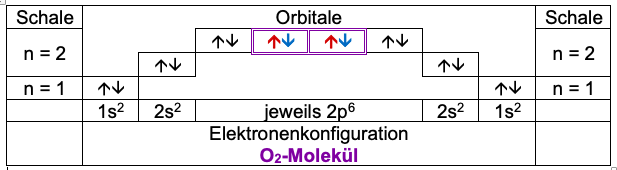
Entsprechend der Hund’schen Regel und des Pauli-Prinzips hat jetzt jedes Atom Edelgaszustand.
Die Schülerinnen der 7.M1 haben versucht, den theoretischen Hintergrund einer Atombindung am Beispiel der Bildung eines Sauerstoffmoleküles aus zwei Sauerstoffatomen in einem stop-motion-video zu veranschaulichen.
Hier können Sie das Video sehen: atombindung_stop-motion

